


در پاسخ به سوال
اسید سولفوریک چیست؟ می توان گفت که، اسید سولفوریک (H2SO4) یکی از مهمترین و پرکاربردترین اسیدهای معدنی در صنایع مختلف است. این ماده شیمیایی به دلیل قدرت خورندگی و اکسیدکنندگی بالا، در تولید بسیاری از محصولات صنعتی مانند کودهای شیمیایی، مواد شوینده، رنگها، باتریها، و پالایشگاههای نفت مورد استفاده قرار میگیرد.
اسید سولفوریک به عنوان یک ترکیب بسیار واکنشپذیر، توانایی جذب آب بالایی دارد و با بسیاری از مواد آلی و معدنی واکنش میدهد. از دیگر ویژگیهای مهم آن میتوان به توانایی بالای آن در حل شدن در آب و تولید حرارت اشاره کرد که باعث میشود در فرآیندهای صنعتی به عنوان یک عامل مهم بهکار گرفته شود.
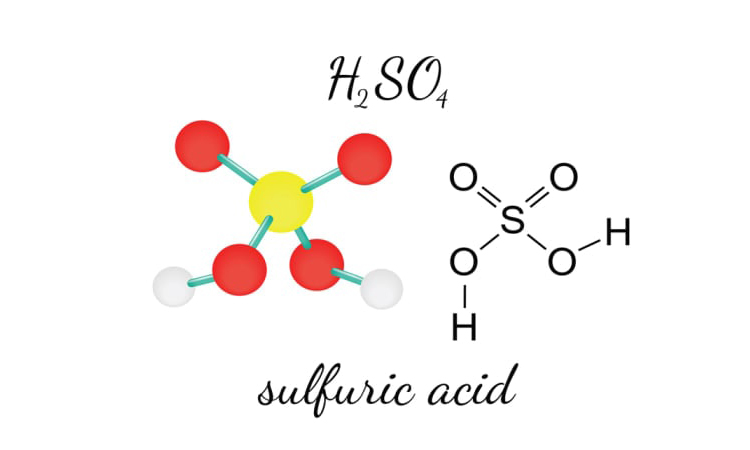
اسید سولفوریک که در گذشته به نام جوهر گوگرد شناخته میشد، یک اسید بسیار قوی با فرمول شیمیایی H2SO4 است که به راحتی در آب حل میشود، حتی در غلظتهای بسیار بالا که در تعریف اسید سولفوریک چیست؟ می توان بیان کرد. این اسید دارای pH حدود 0.5 است و به دلیل ساختار مولکولی قطبی خود، مولکولهای آن میتوانند پیوندهای هیدروژنی قوی تشکیل دهند. به همین دلیل، این اسید دارای نقطه جوش بالاست و به عنوان یک مایع بسیار ویسکوز (با گرانروی بالا) شناخته میشود. این ویژگیها همچنین باعث میشوند که این اسید به خوبی در آب حل شده و محلولهای اسیدی قوی تولید کند.
همچنین به طور طبیعی در گازهای خارجشده از آتشفشانها یافت میشود، در هنگام حل شدن در آب واکنشی به شدت گرمازا دارد؛ به همین علت، باید از اضافه کردن سریع آب به آن خودداری کرد. این اسید تمایل زیادی به جذب آب دارد و در واکنش با مواد دیگر، میتواند مولکولهای هیدروژن و اکسیژن آنها را به صورت آب جدا کند. به عنوان یک ماده خورنده، از جمله کاربرد اسید سولفوریک در تشکیل باران اسیدی نقش دارد، به طوری که آلایندههای موجود در هوا مانند گازهای خروجی از کارخانهها و خودروها با قطرات آب واکنش داده و تولید اسید میکنند. این اسید با بسیاری از فلزات واکنش نشان میدهد و شدت این واکنش با افزایش دما بیشتر میشود، اما بر روی فلزاتی مانند جیوه و سرب تأثیری ندارد. اسید سولفوریک به عنوان یکی از مواد شیمیایی خطرناک دستهبندی شده است.
همچنین اسید سولفوریک در سه غلظت مختلف تولید میشود که هر یک قیمتهای متفاوتی دارند:
اسید سولفوریک (H₂SO₄) یک اسید بسیار قوی و پایدار با خواص ویژهای است. این اسید به شدت جاذب رطوبت است و به راحتی آب را از محیط اطراف خود جذب میکند، به همین دلیل باید در ظروف دربسته نگهداری شود تا از جذب رطوبت جلوگیری گردد. به دلیل همین ویژگی، نوع خالص و بیآب آن در طبیعت یافت نمیشود و بیشتر به صورت رقیقشده در بارانهای اسیدی حضور دارد.
از نظر شیمیایی، اسید سولفوریک به عنوان یک اکسیدکننده قوی عمل میکند و میتواند واکنشهای شدیدی با مواد دیگر ایجاد کند. این ماده همچنین به عنوان یک جاذب رطوبت در گازها عمل میکند و به همین دلیل در فرایندهای شیمیایی خاص و صنعتی کاربرد گستردهای دارد.
اسید سولفوریک یکی از پرکاربردترین مواد شیمیایی است که عمدتاً در تولید کودهای شیمیایی فسفاته به کار میرود. تولید کودهای شیمیایی حدود ۶۰ درصد از بازار مصرف این اسید را به خود اختصاص داده است، در حالی که صنایع معدنی و فلزی حدود ۴ درصد از مصرف جهانی را تشکیل میدهند. در ادامه به کاربرد اسید سولفوریک به تفکیک اشاره میشود.
آن را میتوان در آزمایشگاه از واکنش گاز دیاکسید گوگرد با هیدروژن پراکسید (آب اکسیژنه) تولید کرد. همچنین، یکی دیگر از روشهای سنتز اسید سولفوریک در آزمایشگاه استفاده از الکترولیز سولفات مس(II) است. در این روش، کاتد باید از فلزی با رسانایی بالا مانند مس ساخته شود و آند از موادی مانند پلاتین یا زغال انتخاب شود تا با محلول واکنش ندهد.
فرآیند تولید اسید سولفوریک (H2SO4) از طریق فرآیند مجاورت انجام میشود و یکی از مهمترین روشها در صنعت شیمیایی است. در مرحله اول، گوگرد در حضور اکسیژن میسوزد و دیاکسید گوگرد تولید میشود:
S(s) + O2(g) → SO2(g)
در مرحله بعد، دیاکسید گوگرد با کمک یک کاتالیزگر و اکسیژن اضافی به تریاکسید گوگرد تبدیل میشود:
SO2(g) + O2(g) → SO3(g)
سپس، تریاکسید گوگرد با آب واکنش داده و محلول اسید سولفوریک تشکیل میشود:
SO3(g) + H2O(l) → H2SO4(aq)
با تکرار این مراحل و تزریق گوگرد تریاکسید به محلول اسید سولفوریک، پیروسولفوریک اسید (H2S2O7) تولید میشود.
این اسید یکی از مواد بسیار خطرناک و خورنده است که هنگام کار با آن باید به دقت نکات ایمنی را رعایت کنید تا از بروز حوادث جلوگیری شود.
در صورت تماس اسید با پوست، احتمال سوختگیهای شدید وجود دارد. همچنین اگر به چشمها برخورد کند، ممکن است آسیبهای جدی و حتی کوری ایجاد کند.
بخار اسید بسیار سمی است. بنابراین، هنگام کار با آن بهتر است در محیط باز باشید. اگر در فضای بسته با این اسید کار کنید و بخار آن را تنفس کنید، ممکن است منجر به تحریک شدید بینی و حلق شود و به سیستم تنفسی آسیب جدی وارد کند. در موارد شدید، این بخارات ممکن است باعث سرفههای شدید، تنگی نفس، و حتی آب آوردن ریهها شود که بسیار خطرناک است.
هنگام حمل و نقل اسید باید لباسهای محافظ بپوشید و از تماس مستقیم با پوست خودداری کنید. اگر اسید روی زمین بریزد، از ماسه، شن، یا خاک برای جذب آن استفاده کنید و مراقب باشید که به فاضلاب وارد نشود، زیرا بسیار خطرناک است.
اثرات این اسید به مرور زمان قابل مشاهده است و ممکن است تا سالها باقی بماند. تماس مکرر با اسید سولفوریک میتواند باعث تحریک شدید ریهها، آب آوردن ریهها و بروز بیماریهایی مانند برونشیت شود. همچنین مشکلات تنفسی، معده و دندان از دیگر عوارض تماس طولانی مدت با این ماده است.
این اسید با نامهای دیگری همچون جوهر گوگرد، سولفات دیهیدروژن، و سولفات هیدروژن نیز شناخته میشود و فرمول شیمیایی آن H2SO4 است. این اسید در صورت تماس با چشم یا پوست میتواند آسیبهای جبرانناپذیری ایجاد کند. بلعیدن آن میتواند منجر به سوختگیهای شدید در دهان، مری و معده شود.
اگرچه اسید سولفوریک قابل اشتعال نیست، اما در نزدیکی مواد قابل اشتعال میتواند خطر آتشسوزی ایجاد کند. در صورت بروز حریق، برای خاموش کردن آن باید از پودر خشک استفاده شود، زیرا تماس آب با اسید سولفوریک منجر به واکنش شدید و تولید بخارات خطرناک و گرمای زیاد میشود.
هنگام کار با این اسید، حتماً باید از لباسهای محافظتی، دستکش، کفش ایمنی، عینک ایمنی و ماسکهای تنفسی استفاده کرد. در هنگام رقیقسازی، باید اسید را به آرامی به آب اضافه کرد، زیرا انجام برعکس این کار موجب تولید گرمای شدید و خطرناک میشود.
برای نگهداری اسید سولفوریک باید از تماس آن با ضربات فیزیکی و آب جلوگیری کرد و آن را دور از مواد قابل احتراق مانند کاربیدها، کلراتها، فولمیناتها، نیتراتها، پیکریتها و پودر فلزات نگه داشت.
اسید سولفوریک به دلیل کاربردهای گسترده و خواص شیمیایی منحصر به فرد خود، یکی از پایههای مهم در بسیاری از صنایع شیمیایی و معدنی بهشمار میرود. از تولید کودهای فسفاته تا استفاده در فرآیندهای فلزی و معدنی، این اسید نقشی حیاتی در بهبود کارایی و عملکرد بسیاری از فرآیندهای صنعتی دارد. با این حال، به دلیل خاصیت خورندگی بالا و مخاطراتی که برای سلامت انسان و محیط زیست دارد، استفاده از آن نیازمند رعایت اصول ایمنی و دقت فراوان است. برای تهیه و خرید این محصول با کیفیت بالا، میتوانید با شرکت کیان پرتو تماس بگیرید که تامینکننده مطمئن و معتبر انواع اسید در بازار است.
ترازوی آزمایشگاهی
. ترازوی آزمایشگاهی بل ایتالیا
. ترازوی آزمایشگاهی اوهاس آمریکا
. ترازوی آزمایشگاهی رادواگ لهستان
دستگاه های سنجش آزمایشگاهی
. دستگاه الکتروشیمی (پتانسیواستات / گالوانواستات)
. شوری سنج
دستگاه های آنالیز آب و فاضلاب
. BOD متر
. COD
. جارتست
. فتومتر
دستگاه های فور آزمایشگاهی و انکوباتورها
مواد شیمیایی آزمایشگاهی
. سیگما
. اکروس
. اکسیر
تجهیزات آزمایشگاهی
هات پلیت آزمایشگاهی
آخرین مقالات